
【NOW健康 葉立斌/台北報導】行政院通過「再生醫療雙法」(再生醫療法草案、再生醫療製劑條例草案),力拚立法院本會期通過,經委員會討論後,共6條保留,近日黨團協商。因草案內容涉及醫界及病患權益,爭議不少,衛福部部長薛瑞元18日下午召開臨時記者會,邀請醫師專家背書,澄清外界疑慮。
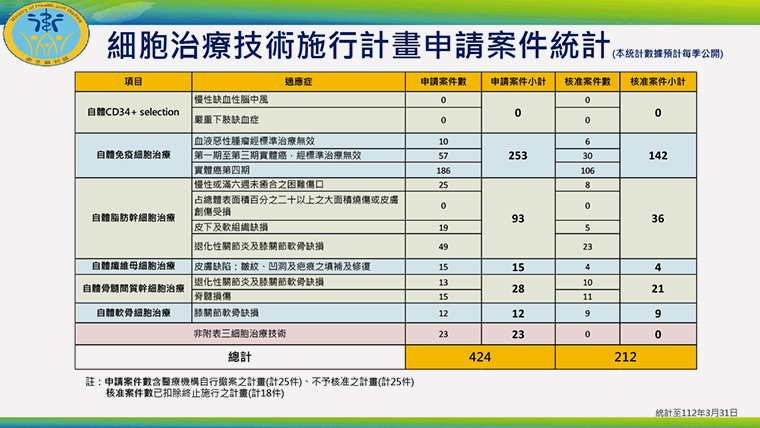
▲細胞治療技術施行計畫申請案件統計。(圖/衛福部提供)
薛瑞元表示,不少重症患者接受現有治療方法後,仍是無效,但受限法規限制,只能至國外尋求細胞療法等最新治療方法。為此,衛福部在2018年公布「特管辦法」後,逐步擴大病患的個人自由和代理範圍,並推動「再生醫療法」草案、「再生醫療製劑條例」草案。
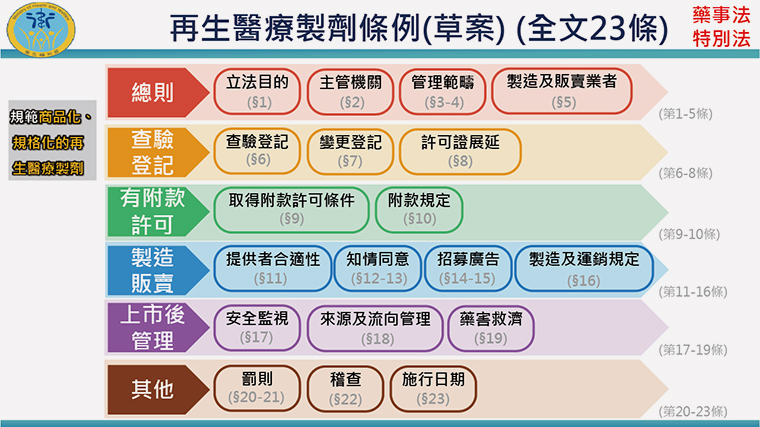
▲再生醫療製劑條例草案共有23條。(圖/衛福部提供)
薛瑞元說,本週再生醫療雙法即將進入黨團協商,最後版本仍要看協商如何,但最近各方專家提出意見,其中有些資訊不太正確,為此公開說明澄清。記者會另邀請中研院基因體研究中心研究員沈家寧丶亞東醫院副院長張至宏、台北榮總醫學研究部主任邱士華等專家,以及食藥署長吳秀梅。
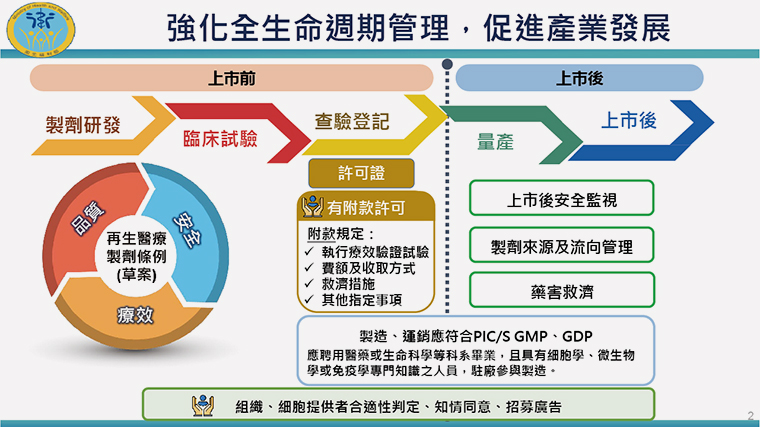
▲條例將從製劑研發初期便提高要求,登記時需加入救濟措施等附款許可,上市後也繼續監督,強化全生命週期管理,促進產業發展。(圖/衛福部提供)
薛瑞元強調,再生醫療雙法的制定目的,主要推動國內再生醫療技術,在有秩序管理環境下進行,確保民眾健康。另加強管理,避免出現假借再生醫療的醫療行為,減少重症患者因不了解而接受不正當的非醫療行為。同時審議會過程嚴謹,以確保安全。
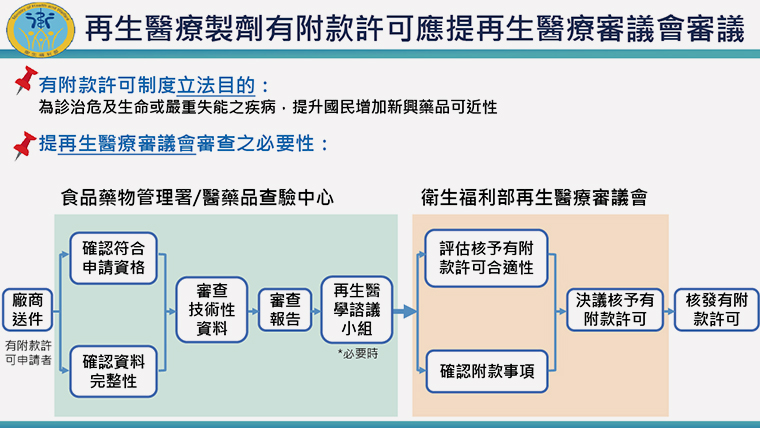
▲立法目的為提升國民增加新興藥品的可近性。(圖/衛福部提供)
部分人士批評,再生醫療雙法通過後,再生醫療沒人管理,且不需人體試驗,甚至特管辦法只要申請就能做。對此,薛瑞元說,都是不恰當的說法,事實上,要求更嚴謹,將針對疾病有非常迫切需求的技術產品,所要做的臨床或人體試驗。母錢我國已有3款再生醫療製劑核准上市,而在國外核准上市者,則有台大醫院胡務亮醫師團隊開發的基因治療製劑,可治療罕見疾病,於2022年獲得歐盟上市許可。

▲台大醫院胡務亮醫師團隊的基因治療製劑或歐盟上市許可。(圖/衛福部提供)
此外,再生醫療雙法上路後,不必公布個案治療效果,對此,衞福部醫事司長劉越萍表示,目前衛福部相關網站只公布個案人數,但醫院須向病人揭露治療成果,把數字講清楚。

▲目前核准案件有87件細胞治療、33件基因治療。(圖/衛福部提供)
針對再生醫療雙法開放醫院設立生技公司,外界疑慮這恐有營利目的。薛瑞元解釋,醫院投資生技公司合作,是否有利益衝突,不是主要需考慮的點。原因在於醫院如想擴充實驗室設備,常有資金及人員上的困難,而生技公司有能力可以建置。再者,一家生技公司可對多家醫院提供服務,新制上路後,相關人員品管回到GMP管理,屆時公司有營利目的、醫療有公益目的,之間沒有衝突。

▲同時對於偽藥、無照藥商與宣稱療效等也有罰則。(圖/衛福部提供)
更多NOW健康報導
▸講座報名/春暖花開耳鼻喉疾病一籮筐 醫師開講解疑惑
▸【全台護心大串聯】心絞痛、高血壓、高血脂講座報名