
【NOW健康 連珮妤/台北報導】近年來,由於生技醫藥領域蓬勃發展,再加上COVID-19疫情催化新藥研發進度,不少研發中的新藥已逐步邁入臨床試驗階段,未來可望為病人帶來更多疾病治療的選擇。
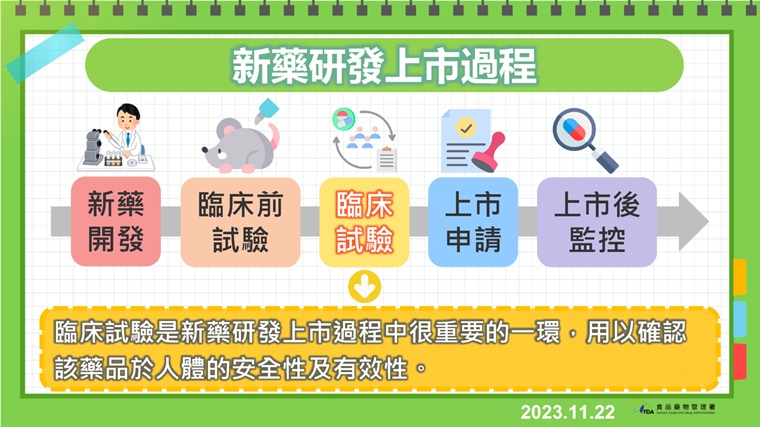
▲新藥研發上市過程。(圖/食藥署提供)
臨床實驗前須先經嚴格審查 有效保障受試者權益
臨床試驗是以發現或證明藥品在臨床、藥理或其他藥學上之作用為目的,而於人體執行的科學研究,在執行前必須先經過食藥署及醫院人體試驗委員會(IRB)的嚴謹審查,充分評估其倫理、安全與科學性後,才會核准臨床試驗進行。

▲臨床試驗執行前應先經過主管機關查核。(圖/食藥署提供)
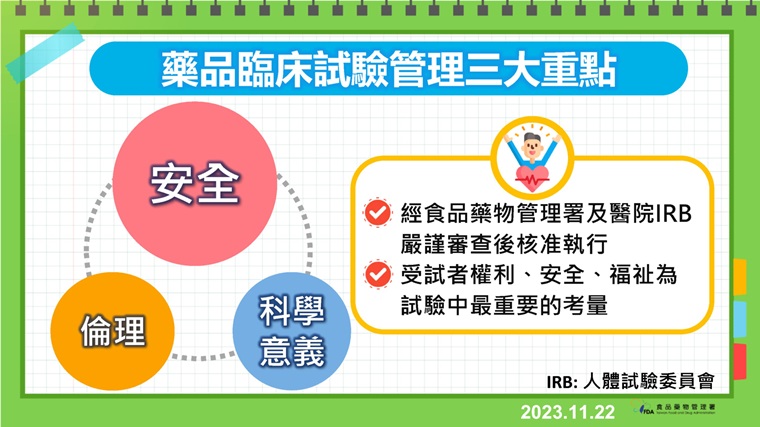
▲藥品臨床試驗管理3大重點。(圖/食藥署提供)
受試者在參加臨床試驗之前,需要先了解臨床試驗的風險與益處、受試者的權益及義務等,在充分了解將參與的臨床試驗相關資訊,並經過審慎評估,自願簽署受試者同意書後才會開始執行相關試驗程序,以保障受試者權益。在試驗執行期間,受試者可以隨時詢問試驗相關問題,也可以隨時退出臨床試驗,對受試者的醫療照護,並不會因為退出試驗而受到影響。此外,試驗團隊也會竭盡全力保護受試者的隱私及個人資料。

▲受試者在參與臨床試驗前,應先簽署受試者同意書。(圖/食藥署提供)

▲受試者參與臨床試驗需留意事項。(圖/食藥署提供)
食藥署舉辦受試者權益推廣活動 積極提升臨床試驗品質
我國在「藥品優良臨床試驗作業準則」(GCP)的管理架構下,規範臨床試驗中試驗主持人、試驗委託者、IRB等各角色的職責,食藥署亦負責執行查核以確保試驗過程符合GCP規範,透過層層把關的機制,來確保臨床試驗的品質並積極保障受試者的權益、安全與福祉。

▲藥品臨床試驗資訊哪裡查詢?(圖/食藥署提供)
另外,食藥署持續精進國內臨床試驗環境,自105年起陸續舉辦受試者權益推廣活動及專業人員教育訓練課程,迄今總計約5,800人次參與,除了向民眾推廣受試者保護知識、建立正確臨床試驗觀念,亦針對試驗專業人員提供涵蓋研究設計、統計、倫理等各面向之教育訓練課程,以全面提升試驗品質並強化對受試者權益之保障。食藥署今年亦推動官網「藥品臨床試驗專區」改版,增設「民眾專區」以及豐富的「教育訓練資訊」,內容豐富多元,歡迎各界多加利用!
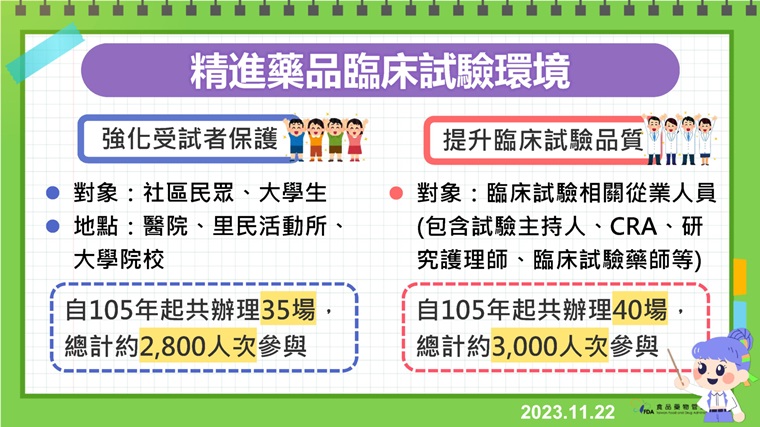
▲食藥署為精進藥品臨床試驗環境,至105年起,已舉辦多項活動與訓練課程。(圖/食藥署提供)
臨床試驗過程中參與的各角色必須妥善履行受試者保護的職責,並建構安全的試驗環境,以提升社會對於臨床試驗的信賴,意即「團隊留心」、「試驗放心」、「民眾安心」,透過三心守護,共同提升臨床試驗執行品質並維護受試者安全與權益。
核稿編輯:陳如頤
更多NOW健康報導
▸趙小僑帶典典回送子鳥 舉辦《1000針的勇氣》簽書會
▸秋冬進補乾癬病友要忌口! 中醫師提醒這個絕對不能沾