【NOW健康 陳敬哲/台北報導】衛福部疾管署5月30日分別與高端和聯亞,簽訂「國內COVID-19疫苗採購契約」,各先預購500萬劑新冠疫苗,卻遭外界質疑2間公司疫苗都未完成第2期與第3期臨床實驗,今(31)日中央流行疫情指揮中心強調,國際間目前主要疫苗,也都在第2期未完成時,陸續在各國完成緊急授權EUA(Emergency Use Authorizations)。
疫苗預採購在研發就要投資 提高開發動機掌握最新資訊
指揮中心疫情監測組組長周志浩表示,預先採購疫苗也就是在研發時期,政府就與廠商簽訂保證契約,一旦取得上市許可時,就能夠按照原訂價格與數量購買,好處有兩點,首先可以加強廠商開發動機,其次能夠掌握最新疫苗狀況許多歐美國家也在臨床實驗階段,讓廠商更有動資與資金加速疫苗研發。
國產疫苗擴大臨床實驗受試人數 比國際疫苗收案件數都多
陳時中強調,高端與聯亞在第2期臨床實驗時,都有擴大收案人數,高端第1劑試驗3,852人,當中846名老年人;第2劑試驗3,815人,當中838人老年人。聯亞第1劑試驗人數3,875人,當中799名老年人;第2劑實驗3,844人,當中792名老年人,比AZ、莫德納、BNT疫苗臨床1期與2期受是人數都多。
陳時中也說,國產疫苗採購價格,因簽保密協定,如果檢察官認為有需要瞭解,可啟動相關程序,國產疫苗2間公司,第2期臨床試驗都擴大近4,000人,比國外疫苗第1期與第2期規模都大很多,重點在確定安全性,如果通過安全性就不會有問題,國外疫苗也都沒有做完第3期臨床實驗,要等緩不濟急。
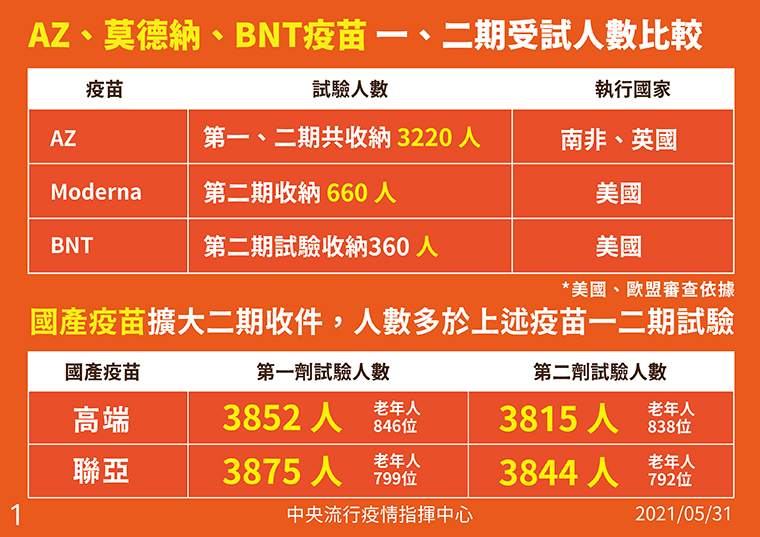
▲新冠國際疫苗與國產疫苗臨床試驗收試人數比較。(圖/中央流行疫情指揮中心提供)
臨床2期完成通過EUA 陳時中:國際慣例台灣非首例
陳時中特別說,目前WHO與多國通過緊急授權EUA疫苗,包含BNT、莫德納、嬌生、牛津AZ,都僅完成第2期臨床試驗,第3期臨床試驗都未完成,BNT疫苗估計在2023年4月,莫德納估計在2022年10月,嬌生估計在2023年5月,牛津AZ疫苗則約在2021年9月在英國完成。
陳時中說明,不論國內外新冠疫苗採購,在科學數字陸續出來時,就要準備開始採買、採購、簽訂契約,疫苗是戰略物資,台灣必須有製造與生產能力,才會用獎勵跟鼓勵措施,去年就定下這個核心政策,政府有必要投資,才能減輕廠商壓力,才能夠達到疫苗國產自製目的。
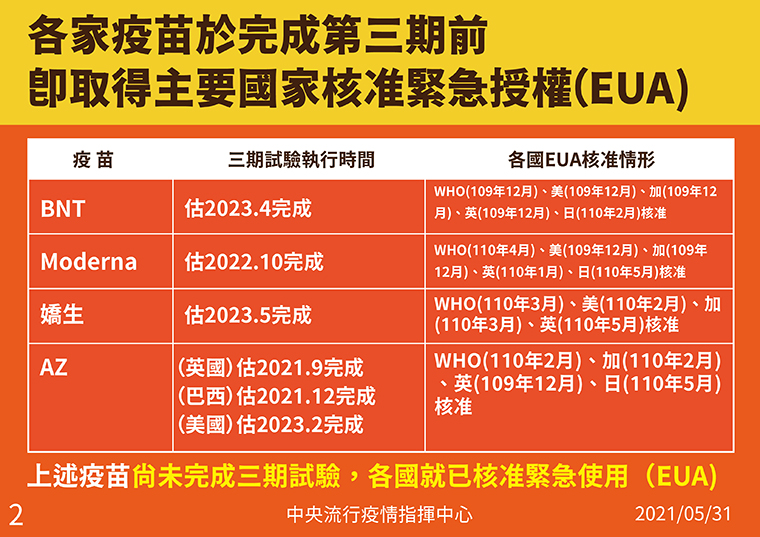
▲新冠國際疫苗完成第3期臨床試驗預計時間。(圖/中央流行疫情指揮中心提供)
更多NOW健康報導
▸中年大叔關鍵時刻「垂頭喪氣」 小心糖尿病帶來危G!
▸開Uber憋尿釀攝護腺炎 與老婆人與人的連結出現障礙