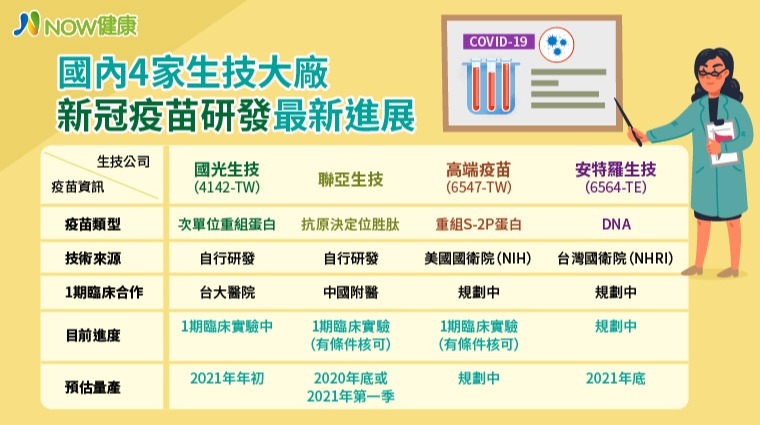
【NOW健康 陳敬哲/綜合報導】衛福部食藥署8月31日宣布,高端疫苗開發的COVID-19候選疫苗,有條件核准1期臨床試驗計畫,這也代表國光、聯亞生技、高端等國內3家研發新冠肺炎疫苗的廠商,均已通過審查,進入1期臨床試驗。
國光搶先人體試驗 預計2021年初量產疫苗
目前國光、聯亞生技、高端等3家疫苗廠皆通過臨床試驗案,目前以國光進度較快,已在台大醫院展開收案試驗,上周完成70收案。至於聯亞生技和高端則需補足部分技術性資料,才可正式臨床試驗。
國光生技表示,新冠疫苗類型是次單元重組蛋白,技術是完全自主研發,目前已經完成食藥署核可,正在與台大醫院合作臨床試驗,由張上淳教授著手,實驗順利將立即展開第2期臨床實驗,預計最快能在2021年量產。
聯亞生技獨創疫苗技術 補件將馬上開啟臨床試驗
另外,食藥署已經有條件核准,聯亞生技新冠疫苗第1期臨床實驗,待補足相關資料完成,預計9月展開第1期人體試驗。聯亞生技表示,疫苗類型是獨創的CTL及Th抗原決定位胜肽,自主研發技術,補件完成將於中國附醫進行臨床試驗。
聯亞生技補充,本試驗將於健康成人受試者施打2劑,受試者分低、中、高3個劑量組,每組20名,預計共收60名受試者,主要目的為探索本疫苗之安全性、耐受性及免疫原性。試驗醫院為中國醫藥大學附設醫院,由黃高彬主任擔任試驗主持人。
聯亞生技強調,全球首創之CTL及Th抗原決定位胜肽,這些胜肽選自於可與人類MHC I和II結合且具免疫優勢之M、S2和N部位。此經過精準設計之Th/CTL混合胜肽可以活化T細胞,並引發T細胞之記憶反應和效用功能。
美國技轉台灣生產疫苗 預計9月人體試驗
高端生技新冠疫苗技術採用重組S-2P蛋白,技術來源是美國國衛院,食藥署也有條件核准第1期臨床實驗,高端生技強調,自己正趕交付文件中,預計9月可開始收案。
高端生技強調,臨床試驗將在台大醫院進行,預計收案45人。第1期臨床試驗重點為疫苗安全性、產生中和抗體的效力,希望年底展開第2期臨床試驗,若順利展開,預計於台灣收案1,500人。
由於高端缺少疫苗前置開發經驗,因此與美國衛生研究院(NIH)簽署新冠肺炎疫苗合約,合作開發,透過全長基因修飾重組S-2P蛋白進行疫苗開發。
食藥署指出,美國衛生研究院與兩家廠商合作研發新冠病毒疫苗,分別為美國生技公司Moderna、高端公司,與高端合作的是蛋白質疫苗,透過蛋白質來刺激抗體。
高端日前提出研發時程,在補件之後,1期人體臨床試驗可開始收案,最快第4季開始啟動2期臨床試驗;另外,今年底可望開始生產疫苗,預計原料全數備齊後,可生產100 萬劑,符合政府釋出的採購量,2021年將可量產超過2,000萬劑疫苗。
台灣國衛院技術也投入疫苗開發 預計2021年底量產
另一間國內新冠疫苗開發廠安特羅生技,由台灣國衛院技術轉移,採用DNA技術研發,但食藥署目前未核准執行人體試驗,因此目前為啟動人體試驗,量產日程計畫在2021年底。
更多NOW健康報導
▸塵蟎誘發過敏體質 想擺脫鼻過敏應先改善鼻腔環境
▸34歲無家族病史竟檢查出大腸癌 這些壞習慣種下禍根