【NOW健康 陳木森/台北報導】立法院日前三讀通過《醫療器材管理法》,將醫療器材管理由過去「藥事法」中抽離,並增訂產品來源及流向資料之建立、部分低風險醫療器材採行電子化登錄、彈性核定許可證效期、與業者主動通報義務等制度。衛生福利部食品藥物管理署強調,新法不僅加速產品上市的期程嘉惠病患,更能推動產業發展,健全醫療器材管理制度。
食品藥物管理署署長吳秀梅表示,隨著科技日新月異及全球高齡化世代的來臨,對於醫療器材的需求量大增,致使醫療器材產業蓬勃發展,為順應國際潮流,配合我國5+2政策方案及新南向政策,制定《醫療器材管理法》,將為我國醫療器材產業邁入國際開啟嶄新的扉頁。
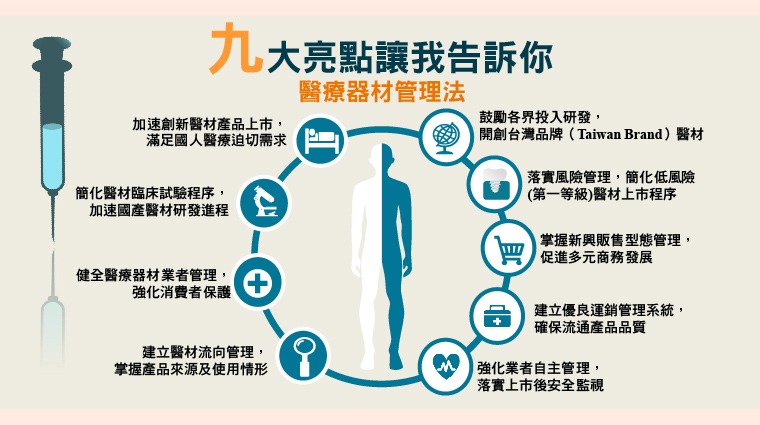
《醫療器材管理法》共85條,食藥署強調,未來將促進產業技術研發及產品創新,將從事醫療器材「設計」並以其名義上市者,納入為醫療器材製造業,鼓勵產業研發及產品創新,希望精進醫療器材加速上市及配套機制。
另外,為完善醫療器材多元化科技產業管理,將納入醫療器材維修業者管理,及規範特定醫療器材之販售及供應型態,同時加強醫療器材業者管理制度,規範醫療器材製造與販賣業者管理、產品來源流向建立、製造品質管理系統要求及運銷管理規定。
食藥署特別說,新法將加強實產品風險分級,部分低風險之醫療器材由查驗登記制度改採電子化線上登錄制度,並以年度申報延續登錄效力。
另一方面,為保護新醫材受試者權益,將規範醫療器材臨床試驗之管理,試驗施行期間發生與臨床試驗相關不良情事,皆應通報,施行期間有安全之虞,得中止或終止臨床試驗,同時也明定執行經公告無顯著風險之醫療器材,臨床試驗無需申請主管機關核准。
食藥署同時提出,強化上市後醫療器材安全監督管理,確保市售醫療器材之品質與安全,部分特定高風險醫療器材須執行安全監視,醫事機構應協助配合辦理,賦予業者主動監控上市後產品之風險管理,並進行必要矯正預防措施。
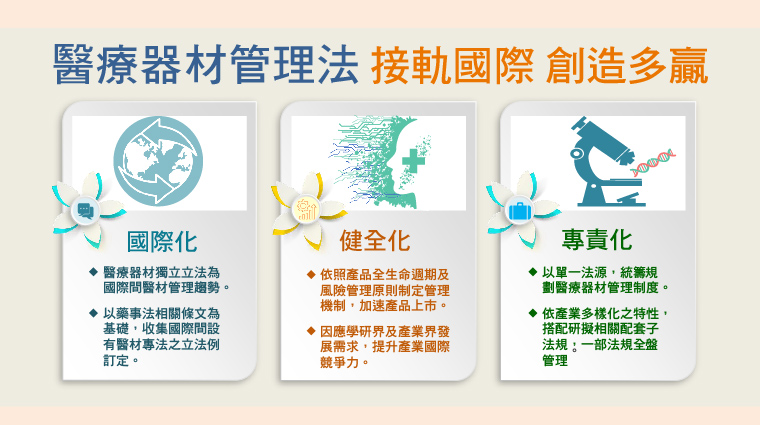
▲《醫療器材管理法》接軌國際,創造多贏。(圖/食品藥物管理署提供)